Kältemaschine & Wärmepumpe: Unterschiede, Funktionsweise und Kreisprozess erklärt

Kältemaschinen und Wärmepumpen nutzen einen physikalischen Effekt, der auf den Wechsel des Aggregatzustands basiert. Wird ein Stoff wie ein Kältemittel unter Druck gesetzt, verflüssigt es sich – bei einer plötzlichen Entspannung verdampft es wieder und entzieht der Umgebung Wärme. Genau dieses Prinzip macht sich der Kältekreisprozess zunutze, um entweder Kälte zu erzeugen oder Wärme nutzbar zu machen.
Doch wie funktioniert dieser Prozess genau? Welche Rolle spielen Druck, Temperatur und Verdampfung? In diesem Artikel erfahren Sie, wie Kältemaschinen und Wärmepumpen arbeiten und worin ihre Unterschiede liegen.
Wie Temperatur und Druck den Aggregatzustand beeinflussen
Die Temperaturen und Luftdrücke auf unserem Planeten sind glücklicherweise meist angenehm für uns Menschen. Bei diesen Luft-Druck-Bedingungen ist beispielsweise Butan gasförmig, das heißt, die Butan-Moleküle, zusammengesetzt aus Kohlenstoff und Wasserstoff, tanzen wild hin und her. Presst man dieses Gas jedoch zusammen, nimmt man den Molekülen diesen Platz zum Tanzen. Gleiches gilt, wenn man es stark abkühlt. Dieses Tanzverbot lässt sich so weit treiben, bis diese Moleküle nicht mehr gasförmig bleiben, sondern flüssig werden.
Sperrt man die abgekühlte oder unter Druck gesetzte Flüssigkeit ein, so lässt sich Butan als solches in Feuerzeugen umhertragen. Zwei Möglichkeiten bestehen also, will man dieses Gas als Flüssigkeit transportieren:
Entweder den Überdruck für Butan auf mehr als 2 bar erhöhen oder die Temperatur auf unter – 0,5°C senken, dann einsperren und fertig. Bleibt der Behälter, also das Feuerzeug, unter Druck, bleibt auch das enthaltene Butan flüssig. Lässt man Butan jedoch austreten, also sich entspannen, so wird es wieder gasförmig. Der springende Punkt ist, dass wir bei diesem Vorgang, also der Entspannung des ehemals flüssigen Butans, mitten in der Kältetechnik baden. Butan siedet, also beginnt zu kochen, bei Umgebungstemperaturen.
Das Sieden von Wasser läuft nur unter Zugabe von Energie. Diese Energie liefert üblicherweise die Herdplatte beim Kochen. Das Sieden von Butan läuft ebenfalls nur unter Zugabe von Energie.
Dass wir keine Herdplatte benötigen, liegt an der Tatsache, dass Butan eben schon bei – 0,5 °C siedet. Es nimmt beim Sieden aber zwingend Energie aus der Umgebung auf. Die Umgebung wird bei diesem Vorgang zwangsläufig kühler.

Kältemaschine Kreisprozess: So funktioniert der thermodynamische Ablauf
Eigentlich möchte man diesen Kühlprozess laufen lassen, die zwischenzeitlich siedende Flüssigkeit aber dann zurückgewinnen und in einem Kreisprozess zirkulieren lassen. Genau das passiert bei einer Kältemaschine oder auch bei einer Wärmepumpe: Eine leicht siedende Flüssigkeit wird durch Entspannung verdampft und nimmt dabei zwangsläufig eine Menge Energie auf. Um den Kreisprozess zu schließen, setzt ein Kompressor das dann gasförmige Medium wieder unter Druck.
Er nimmt dem Fluid gewissermaßen die soeben gewonnene Bewegungsfreiheit wieder ab. Statt der Bewegung von Molekülen äußert sich der immer noch hohe Energiegehalt des Fluids als hohe Temperatur, also als Wärmeenergie. "Wild tanzen" oder "heiß sein" ist demnach das Wechselspiel in diesem Kreisprozess.
Der Kompressor muss natürlich mit Energie von außen angetrieben werden. Aber das Tolle an diesem Prozess ist, dass zwar die hohe Temperatur durch die Kompression herbeigeführt wird, aber der Energiezuwachs am größten ist während des Siedevorgangs. Es kann also gut sein, dass man, obwohl man nur eine elektrische Leistung von 1 Kilowatt (kW) anlegt, sagenhafte 4 kW Wärmeenergie abnehmen kann.
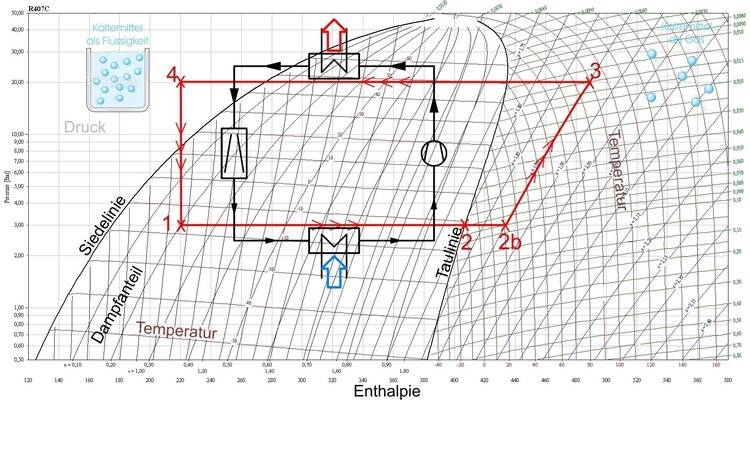
Log(p),h-Diagramm: Wie der Kreisprozess einer Kältemaschine dargestellt wird
Diagramme vereinfachen oft die Sicht der Dinge, so auch das Log(p),h-Diagramm. Man sollte in diesem Zusammenhang zuerst einmal die Bedenken ablegen, man könnte diese Sammlung von Kurven niemals durchblicken. Es bleiben am Ende einige wenige Zusammenhänge übrig, um die Funktionsweise einer Kältemaschine oder Wärmepumpe erfassen zu können.
Sie kennen das schon alles? Dann finden Sie vielleicht den richtigen Job auf www.gebäudehelden.de.
log(p)
Um den Durchblick zu behalten, haben die Menschen Zahlen entwickelt. Die Naturwissenschaften lassen sich so deutlich besser erfassen, als wenn man nur die Eigenschaften viel oder wenig benutzen würde. Unser Zahlensystem kann man dabei grafisch an einem Zahlenstrahl auftragen. Der Abstand von der Zahl Eins zur Zwei und dann zur Drei ist immer gleich groß. Das hilft, wenn man sich den Abstand zwischen zwei Städten in Kilometern vorstellen möchte. Aber Prozesse laufen nicht immer so schlicht ab wie die Wanderung von Dortmund nach Köln.
Beispielsweise der Druck auf ein verdampfendes Kältemittel hat einen komplizierten Einfluss auf den Energiegehalt dieses Kältemittels. Daher verlässt man zur besseren Darstellung dieses Zusammenhangs das gewohnte Zahlensystem und bedient sich des Logarithmus einer Zahl. Einige technische Diagramme verwenden diesen Trick.
Es hilft ein wenig, wenn man weiß, der Logarithmus von 10 ist 1, der von 100 ist 2, der von 1000 ist 3 usw. Obwohl sich also die Werte von Zahlen erheblich unterscheiden, kann der Logarithmus dieser Zahlen auf einem Zahlenstrahl überraschend nah beieinander liegen. So ist jedenfalls die senkrechte Achse, also die y-Achse des Diagramms aufgebaut. Sie stellt den Druck mit logarithmischer Teilung dar und steigt, wie gewohnt von unten nach oben an. „log(p)“ steht also für logarithmisch aufgetragenen Druck.
h für Enthalpie
Die Enthalpie wird mit dem Buchstaben „h“ abgekürzt und ist aus dem Englischen für „heat content“ abgeleitet. Am einfachsten lässt der Begriff sich also mit „Wärmeinhalt“ übersetzen und wird in der Einheit Joule (J) angegeben. Und die spezifische Enthalpie „h“ bezeichnet dann den Wärmeinhalt bezogen auf eine Masse, spezifisch eben. Der Wärmeinhalt bezogen auf eine Masse erhält dann in der Regel die Einheit Kilojoule pro Kilogramm (kJ/kg). Waagerecht nimmt also der Wärmeinhalt von links nach rechts zu.
Ablesebeispiel: Kältemaschine und Wärmepumpe im Diagramm verstehen
Dieses Diagramm gilt nur für ein bestimmtes Kältemittel, nämlich R407C. Das R in R407C steht übrigens schon für Refrigerant, also Kältemittel, weshalb man schlicht von R407C sprechen kann und allen Wissenden dann klar ist, dass es sich um ein Kältemittel handelt.
Das abgebildete Log(p),h-Diagramm beinhaltet ein Ablesebeispiel im Punkt 1. In diesem Diagramm sind die Informationen abzulesen für einen Zustand des Kältemittels bei einem Druck (p) von 3,0 bar und einer Enthalpie (h) von 220 kJ/kg. Es fällt auf, dass dieser Punkt unterhalb der erkennbaren Glocke liegt. Es handelt sich daher ganz klar um das bereits siedende Kältemittel.
Die Eingeweihten wissen nämlich, links von der Glocke ist alles flüssig, rechts davon existiert überhitzter Dampf. Der Dampfanteil im Punkt 1 liegt bei genau 0,2, also 20%. Der Rest, also noch 80% des Kältemittels ist flüssig. Die Temperatur des Kältemittels liegt bei –17°C. Solange jetzt die Umgebung auch nur ein wenig wärmer ist als –17°C, verdampft dieses Kältemittel und der Zustand verändert sich bei ansonsten gleichem Druck auf der waagerechten Drucklinie nach rechts.
Die Enthalpie, also der Wärmeinhalt, nimmt dabei kontinuierlich zu. – 17 °C und die Funktionsweise des Verdampfungsprozesses sorgt dafür, dass das siedende Fluid Energie aufnimmt und verdampft. In einem Glasbehälter würde man tatsächlich eine blubbernde Flüssigkeit sehen, ähnlich wie in einem Kochtopf mit Wasser.
Auswirkungen auf den Kältekreislauf: Was beim Wechsel des Aggregatzustands passiert
Im Kältekreislauf würde der Ablesepunkt 1 im Diagramm eine Stelle im Verdampfer einer Kälteanlage oder Wärmepumpe markieren. Dort würde vom Kältemittel die Energie aus der Umgebung aufgenommen, sei es das Kühlhaus (Kälteanlage) oder das Erdreich (Wärmepumpe). Für dieses Kältemittel und bei genau 3,0 bar Druck würde die Verdampfung fortlaufend bis zum Punkt 2 beobachtbar sein.
Dann wäre das Kältemittel vollständig verdampft. In dem Kreisprozess einer Kältemaschine würde sicherheitshalber noch etwas gewartet, um das Kältemittel ganz sicher dampfförmig zu erhalten. Die sogenannte Überhitzung würde erzwungen, der Punkt 2b wird besetzt.
Für den dann in Aktion tretenden Kompressor darf nämlich keine noch so geringe Flüssigkeitsmenge vorhanden sein, er könnte sonst zerstört werden. Jedenfalls beträgt der Enthalpiegehalt nun 432 kJ/kg und ist damit um 212 kJ/kg gestiegen – und zwar nur durch Umgebungswärme!
Kompressor der Kältemaschine: Warum Verdichtung entscheidend ist
Die Funktionsweise des Kompressors ist entscheidend: Er verdichtet das Kältemittel und hebt dessen Temperatur an. Häufig werden die skurril anmutenden Scrollverdichter in der Kältetechnik eingesetzt. Im Ablesebeispiel auf Seite 11 schafft der Kompressor eine Verdichtung auf 20 bar und damit auf den Punkt 3 im Diagramm.
Man kann jetzt ablesen, welche Temperatur das R407C angenommen hat, nämlich annähernd 100 °C bei einer Enthalpie von mittlerweile 488 kJ/kg. Während der Kompression hat die Enthalpie ja nochmals ein wenig zugelegt (56 kJ/kg). Der Hauptanteil (212 kJ/kg) stammt aber aus der Verdampfung.
Verflüssigung im Kältekreisprozess: Wärme abgeben und Energie nutzen
Wer den Kältekreislauf kennt, erwartet jetzt bereits den nächsten Schritt im Diagramm. Denn auf dem hohen Temperaturniveau kann jetzt Wärme an die Umgebung abgegeben werden. Dabei wird ganz normal der Taupunkt unterschritten und mit weiter abnehmender Temperatur verflüssigen sich immer größere Anteile des Kältemittels.
Bei konstantem Druck wandert also der Zustand im Diagramm auf Seite 11 von Punkt 3 zu 4. Die Enthalpie nimmt erheblich ab. Klar, die Energie wird an die Umgebung oder, im Falle einer Wärmepumpe, an eine Fußbodenheizung abgegeben.
Drucksenkung in der Kältemaschine: Wie Expansion Kälte erzeugt
Senkt man jetzt den Druck, so wäre es, als würde man das Gas urplötzlich freisetzen, sprich entspannen. Der Zustand vom R407C wird mittels eines Expansionsventils von Punkt 4 zu 1 verändert und ist damit wieder in Ausgangsposition.
Dieser Kreisprozess lässt sich also eindeutig einzelnen Komponenten zuordnen und im Log(p),h-Diagramm nachzeichnen. Über den Zusammenhang des Massenstroms eines eingesetzten Kältemittels kann auch die Leistung genau vorausgesagt werden. Der Zusammenhang ist ganz einfach.
Während im normalen Sprachgebrauch die Energie in Kilowattstunden (kWh) und die Leistung in Kilowatt (kW) benannt wird, zeigt das Log(p),h-Diagramm bei der Enthalpie den Energiegehalt in Kilojoule pro Kilogramm (kJ/kg).
- Der Bezug ist dann:
1 Joule = 1 Wattsekunde oder 1 J = 1 Ws - Und dann gilt natürlich auch:
1 J/s = 1 W
Bei einer Enthalpiedifferenz von insgesamt 268 kJ/kg kann man annehmen, dass man, würde man ein Kilogramm pro Sekunde (kg/s) unter diesen Umständen einsetzen, eine Wärmepumpe mit ca. 268 kW Leistung betreiben würde.

Kältemittel in Kältemaschinen: Welche Stoffe im Kreislauf verwendet werden
Die hier geschilderten Fakten lassen nicht nur den Eindruck entstehen, dass in der Praxis auch eine echte Kältemaschine mit Butan betrieben werden könnte. Es ist tatsächlich so, dass auch Butan oder Methan eingesetzt werden, um effiziente Kälte-Prozesse ablaufen zu lassen. Allerdings gibt es Beschränkungen bezüglich der gesetzlichen Vorgaben für die Füllmenge von Kälteanlagen mit diesen Brenngasen. Man befürchtet, dass diese Brennstoffe eine Gefahr darstellen könnten, wenn sie unkontrolliert austreten.
Denkbar und bereits in der Erprobung ist aber auch der Einsatz von herkömmlichem Wasser. Auch Wasser kann ja bekanntlich bei Umgebungstemperaturen verdunsten. Man muss dazu nur den Umgebungsdruck stark vermindern. Also könnte man einen Kreisprozess im annähernden Vakuum laufen lassen und würde mit dem völlig ungefährlichen Wasser als Kältemittel arbeiten können.







